肝癌是中國高發惡性腫瘤,因治療方案有限、藥物有效反應率低,在中國肝癌患者的死亡率高。近年來,雖然有侖伐替尼等靶向藥物用于臨床,但有效率較低;現有的分子分型均無法用于指導藥物治療。因此,臨床亟需研究可以指導肝癌精準用藥的分子分型和揭示新的耐藥靶點。
4月8日,河南省腫瘤醫院肝膽胰外科主任韓風團隊與北京大學第一醫院張寧教授團隊、北京大學腫瘤醫院吳健民教授團隊基于多年緊密合作,在國際期刊《Cancer Cell》聯合發表研究論文《Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer》,影響因子50.3。

河南省腫瘤醫院肝膽胰外科韓風主任團隊的副主任醫師莊昊,與北京大學第一醫院博士后楊慧、程景輝博士、徐紅闖助理研究員及汪一諾博士為共同第一作者,張寧教授、吳健民教授為并列通訊作者,我院肝膽胰外科楊楠木副主任醫師及2021級碩士研究生張婷婷作為主要作者參與該項研究。
該研究基于中國肝癌患者的手術樣本,建立了144位肝癌患者的類器官生物庫,包括399個腫瘤類器官品系。
該研究通過對組織和類器官的外顯子及轉錄組測序,揭示了類器官的異質性特征;通過對肝癌靶向藥的大規模藥敏測試,結合類器官的轉錄組數據和機器學習模型,揭示了可以指導用藥的肝癌藥敏分子分型;進一步機制研究,發現c-Jun 高表達是造成肝癌耐藥的一個重要因素,篩選靶向藥聯合用藥新方案,通過藥化方法合成新藥PKUF-01,為肝癌的精準診療提供依據和線索。
亮點一:高質量肝癌類器官生物庫的建立
團隊對肝癌患者的手術標本多點取樣,成功建立了涵蓋144位患者,399個腫瘤位點的肝癌類器官生物庫。通過HE染色,證實類器官保留了患者的病理學特征。通過對類器官和對應的患者標本的免疫熒光、免疫組化染色,證實肝癌類器官與肝癌患者的診斷標記物的一致性。
團隊選取99個位點,進行組織和對應類器官的外顯子、轉錄組測序,分析了組織與對應類器官的基因組特征。從體細胞突變(somatic mutations)、拷貝數變異(copy number alterations, CNA)和轉錄組相似性等多維度驗證了類器官生物庫高度保留組織樣本的分子特征。綜上證實了本團隊高質量類器官生物庫的建立。

亮點二:瘤內基因組異質性研究的突破
基于外顯子測序結果,團隊對基因組異質性進一步研究,團隊在部分患者的多區域類器官中,發現腫瘤體細胞突變、拷貝數變異在多區域類器官的顯著不同。
為了系統地研究基因組的瘤內異質性(intra-tumor heterogeneity, ITH),團隊繪制了每個多區域取樣患者的進化樹。為了研究基因組異質性是否會導致藥敏的異質性,團隊研究了原發性肝癌一線靶向藥索拉非尼、侖伐替尼的靶基因在患者中的差異表達。發現部分患者中,索拉非尼、侖伐替尼的靶基因在多區域中有顯著的表達差異,且不同位點間存在藥敏異質性。

亮點三:大規模篩選肝癌靶向藥新方案
本團隊選取臨床上常用的肝癌一線藥物索拉非尼、侖伐替尼,常用的二/三線藥物瑞戈非尼、阿帕替尼、貝伐單抗,以及針對膽管癌FGFR2融合的藥物培米替尼、膽管癌IDH1突變的藥物艾伏尼布,對類器官生物庫進行大規模藥物篩選,以探索肝癌藥敏分子分型。
結合376個肝癌位點的7種肝癌靶向藥藥敏篩選結果,已完善的患者臨床藥敏信息,團隊進一步比對了患者臨床藥敏和類器官藥敏。在14個有完整治療隨訪的患者中,類器官的藥敏與臨床患者的藥物治療效果是一致的。此外,團隊也用動物模型驗證了和類器官結果的一致性。這些為進一步通過類器官研究藥敏分子分型奠定了基礎。

亮點四:解析肝癌臨床靶向藥的藥敏分子分型
在基因組層面上,基因組異質性曾被報道為是導致耐藥性的重要因素,團隊使用多區域類器官研究了基因組異質性與肝癌靶向藥藥敏的關聯。
與敏感組相比,在侖伐替尼耐藥組中發現mutation-ITH和CNA-ITH水平顯著升高,表明ITH與侖伐替耐藥相關。團隊還分別研究了基因組ITH與索拉非尼、瑞戈非尼和阿帕替尼藥敏的相關性。提示基因組ITH在一定水平上,可以預測藥物敏感度。團隊結合255個類器官的轉錄組數據和機器學習模型,解析了肝癌臨床靶向藥侖伐替尼,索拉非尼、瑞戈非尼、阿帕替尼的藥敏分子分型。

亮點五:以c-Jun為核心的耐藥靶點
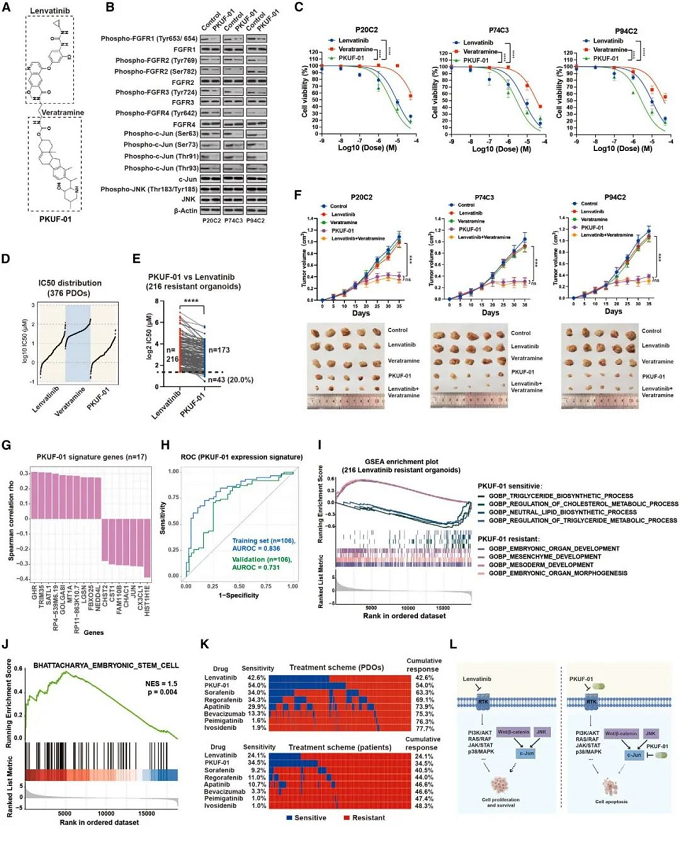
團隊以肝癌一線藥侖伐替尼為例,具體研究其關鍵耐藥靶點。團隊進行了蛋白質-蛋白質相互作用網絡分析,發現JUN在該網絡中處于核心地位。進一步通過敲低和過表達c-Jun的方法,驗證侖伐替尼藥物敏感度的變化。
此外,團隊引入三種c-Jun的抑制劑Veratramine, SR11302 和NY2267,與侖伐替尼聯用,增強侖伐替尼的藥物敏感度。形成c-Jun為耐藥靶點的侖伐替尼聯合用藥新方案;揭示了JNK和Wnt/β-catenin作為c-Jun的上游,介導了侖伐替尼耐藥的機制。

亮點六:合成PKUF-01,提升肝癌治療效果
基于團隊發現的侖伐替尼和c-Jun抑制劑的協同用藥效果,團隊將侖伐替尼和c-Jun抑制劑藜蘆胺連接,合成PKUF-01。
團隊在侖伐替尼耐藥的類器官中,檢測到PKUF-01對腫瘤更好的殺傷效果,并在裸鼠成瘤實驗中進一步證實了PKUF-01的體內腫瘤殺傷效果。最后,團隊揭示了PKUF-01的藥敏分子分型,揭示了PKUF-01耐藥類器官中,干性相關基因的高表達,提示PKUF-01的耐藥可能與腫瘤干性相關。
4月8日,河南省腫瘤醫院肝膽胰外科主任韓風團隊與北京大學第一醫院張寧教授團隊、北京大學腫瘤醫院吳健民教授團隊基于多年緊密合作,在國際期刊《Cancer Cell》聯合發表研究論文《Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer》,影響因子50.3。

河南省腫瘤醫院肝膽胰外科韓風主任團隊的副主任醫師莊昊,與北京大學第一醫院博士后楊慧、程景輝博士、徐紅闖助理研究員及汪一諾博士為共同第一作者,張寧教授、吳健民教授為并列通訊作者,我院肝膽胰外科楊楠木副主任醫師及2021級碩士研究生張婷婷作為主要作者參與該項研究。
該研究基于中國肝癌患者的手術樣本,建立了144位肝癌患者的類器官生物庫,包括399個腫瘤類器官品系。
該研究通過對組織和類器官的外顯子及轉錄組測序,揭示了類器官的異質性特征;通過對肝癌靶向藥的大規模藥敏測試,結合類器官的轉錄組數據和機器學習模型,揭示了可以指導用藥的肝癌藥敏分子分型;進一步機制研究,發現c-Jun 高表達是造成肝癌耐藥的一個重要因素,篩選靶向藥聯合用藥新方案,通過藥化方法合成新藥PKUF-01,為肝癌的精準診療提供依據和線索。
亮點一:高質量肝癌類器官生物庫的建立
團隊對肝癌患者的手術標本多點取樣,成功建立了涵蓋144位患者,399個腫瘤位點的肝癌類器官生物庫。通過HE染色,證實類器官保留了患者的病理學特征。通過對類器官和對應的患者標本的免疫熒光、免疫組化染色,證實肝癌類器官與肝癌患者的診斷標記物的一致性。
團隊選取99個位點,進行組織和對應類器官的外顯子、轉錄組測序,分析了組織與對應類器官的基因組特征。從體細胞突變(somatic mutations)、拷貝數變異(copy number alterations, CNA)和轉錄組相似性等多維度驗證了類器官生物庫高度保留組織樣本的分子特征。綜上證實了本團隊高質量類器官生物庫的建立。

亮點二:瘤內基因組異質性研究的突破
基于外顯子測序結果,團隊對基因組異質性進一步研究,團隊在部分患者的多區域類器官中,發現腫瘤體細胞突變、拷貝數變異在多區域類器官的顯著不同。
為了系統地研究基因組的瘤內異質性(intra-tumor heterogeneity, ITH),團隊繪制了每個多區域取樣患者的進化樹。為了研究基因組異質性是否會導致藥敏的異質性,團隊研究了原發性肝癌一線靶向藥索拉非尼、侖伐替尼的靶基因在患者中的差異表達。發現部分患者中,索拉非尼、侖伐替尼的靶基因在多區域中有顯著的表達差異,且不同位點間存在藥敏異質性。

亮點三:大規模篩選肝癌靶向藥新方案
本團隊選取臨床上常用的肝癌一線藥物索拉非尼、侖伐替尼,常用的二/三線藥物瑞戈非尼、阿帕替尼、貝伐單抗,以及針對膽管癌FGFR2融合的藥物培米替尼、膽管癌IDH1突變的藥物艾伏尼布,對類器官生物庫進行大規模藥物篩選,以探索肝癌藥敏分子分型。
結合376個肝癌位點的7種肝癌靶向藥藥敏篩選結果,已完善的患者臨床藥敏信息,團隊進一步比對了患者臨床藥敏和類器官藥敏。在14個有完整治療隨訪的患者中,類器官的藥敏與臨床患者的藥物治療效果是一致的。此外,團隊也用動物模型驗證了和類器官結果的一致性。這些為進一步通過類器官研究藥敏分子分型奠定了基礎。

亮點四:解析肝癌臨床靶向藥的藥敏分子分型
在基因組層面上,基因組異質性曾被報道為是導致耐藥性的重要因素,團隊使用多區域類器官研究了基因組異質性與肝癌靶向藥藥敏的關聯。
與敏感組相比,在侖伐替尼耐藥組中發現mutation-ITH和CNA-ITH水平顯著升高,表明ITH與侖伐替耐藥相關。團隊還分別研究了基因組ITH與索拉非尼、瑞戈非尼和阿帕替尼藥敏的相關性。提示基因組ITH在一定水平上,可以預測藥物敏感度。團隊結合255個類器官的轉錄組數據和機器學習模型,解析了肝癌臨床靶向藥侖伐替尼,索拉非尼、瑞戈非尼、阿帕替尼的藥敏分子分型。

亮點五:以c-Jun為核心的耐藥靶點
團隊以肝癌一線藥侖伐替尼為例,具體研究其關鍵耐藥靶點。團隊進行了蛋白質-蛋白質相互作用網絡分析,發現JUN在該網絡中處于核心地位。進一步通過敲低和過表達c-Jun的方法,驗證侖伐替尼藥物敏感度的變化。
此外,團隊引入三種c-Jun的抑制劑Veratramine, SR11302 和NY2267,與侖伐替尼聯用,增強侖伐替尼的藥物敏感度。形成c-Jun為耐藥靶點的侖伐替尼聯合用藥新方案;揭示了JNK和Wnt/β-catenin作為c-Jun的上游,介導了侖伐替尼耐藥的機制。

亮點六:合成PKUF-01,提升肝癌治療效果
基于團隊發現的侖伐替尼和c-Jun抑制劑的協同用藥效果,團隊將侖伐替尼和c-Jun抑制劑藜蘆胺連接,合成PKUF-01。
團隊在侖伐替尼耐藥的類器官中,檢測到PKUF-01對腫瘤更好的殺傷效果,并在裸鼠成瘤實驗中進一步證實了PKUF-01的體內腫瘤殺傷效果。最后,團隊揭示了PKUF-01的藥敏分子分型,揭示了PKUF-01耐藥類器官中,干性相關基因的高表達,提示PKUF-01的耐藥可能與腫瘤干性相關。

